Quando si parla di nucleare lo si associa sempre alla produzione di energia o alle armi di distruzione di massa. Si conosce meno, invece, l’importanza del nucleare nel quotidiano. Ne abbiamo parlato con Davide Bortot, ricercatore del Dipartimento di Energia del Politecnico di Milano, che si occupa di misure e strumentazione nucleari applicate in ambito medico.
Quali possono essere le applicazioni del nucleare nella vita di tutti i giorni?
Uno dei campi più comuni di applicazione delle radiazioni è quello medicale. In questo ambito, ad esempio, si possono distinguere due grandi famiglie: la diagnostica per immagini e la radioterapia. La prima comprende una serie di tecniche non invasive utilizzate per andare a fotografare delle situazioni più o meno critiche di un paziente. Sono degli esami che tutti conoscono; si parte dalla semplice radiografia, fino ad arrivare alla tomografia computerizzata (CT) in 3D. Tali tecniche sono chiamate “in trasmissione”: da un generatore parte una radiazione che attraversa il corpo del paziente e, a seconda di quello che la radiazione incontra, viene prodotta un’immagine. Ciò avviene grazie alla diversa tipologia di interazione della radiazione con il materiale, in questo caso il tessuto umano. È possibile costruire un’immagine in due dimensioni su una semplice radiografia, o in tre dimensioni se è una tomografia del volume che si vuole andare a investigare, di un organo o di una parte del corpo.

E quali sono le tecniche di emissione?
In questo caso è il paziente stesso che diventa “radioattivo”, nel senso che gli viene somministrato un farmaco che è chiamato radiofarmaco, perché ha all’interno un tracciante radioattivo. Il paziente viene poi sottoposto a un’indagine con dei rivelatori all’esterno, che vanno a misurare la radiazione emessa dal corpo. Le tecniche sono principalmente due: la SPECT (Single Photon Emission Computed Tomography) e la PET (Positron Emission Tomography). Tali tecniche sono molto rilevanti, poiché sono in grado di fornire informazioni di tipo funzionale sull’organo sotto studio. Mentre le tecniche in trasmissione, come la CT, mostrano in maniera molto chiara la morfologia del paziente e permettono di individuare, ad esempio, una lesione tumorale. La PET, al contrario, misura in maniera più accurata la funzionalità di un organo, perché viene indagato, in spazio e in tempo, il trasporto del radiofarmaco all’interno del corpo del paziente. Di conseguenza si può studiare la funzionalità dell’organo e capire se è corretta, oppure se ci sono delle anomalie rispetto al normale funzionamento.
Non ci sono rischi con l’utilizzo dei radiofarmaci?
Il paziente non può rimanere radioattivo a lungo, perciò i radio farmaci sono costituiti da radionuclidi che hanno tempi di dimezzamento abbastanza brevi. Devono essere quindi prodotti ad hoc quotidianamente, da ospedali o centri che, generalmente, ospitano degli acceleratori di particelle.
Come possono essere applicate le radiazioni in ambito medicale oltre la diagnostica?
L’utilizzo delle radiazioni nucleari per il trattamento dei tumori è l’altro grande filone dell’applicazione medicale. Per la terapia delle neoplasie le tecniche più utilizzate sono essenzialmente tre: la chirurgia, la chemioterapia e la radioterapia. Quindi, a seconda della tipologia del tumore, dello stato di avanzamento, delle caratteristiche del paziente, si può optare per una delle tre o a volte anche la combinazione di due o tre. L’idea della radioterapia è proprio quella di sfruttare la radiazione al fine di distrugge il tumore, andando a colpire le cellule tumorali, tenendo sempre a mente che si devono preservare il più possibile i tessuti sani. C’è sempre un compromesso tra la quantità di radiazione che si possono impartire a un determinato tessuto, in modo tale da limitare le complicazioni ai tessuti sani, e combattere le cellule tumorali.
Quali sono le tecniche più avanzate nella cura dei tumori?
La radioterapia, a sua volta, può essere suddivisa in radioterapia convenzionale (basata su elettroni o radiazione elettromagnetica) e adroterapia, cioè la terapia tumorale con adroni, tra i quali si annoverano i protoni, gli ioni carbonio e i neutroni. L’adroterapia è particolarmente indicata per la cura dei tumori radioresistenti, quei tumori che non rispondono alla radioterapia tradizionale con raggi X o per i tumori inoperabili. Il grande vantaggio della adroterapia, rispetto alla terapia convenzionale, è quella di sfruttare il fatto che questo tipo di particelle, specialmente protoni e ioni carbonio, hanno una diversa modalità di interagire con la materia, anche con il corpo del paziente, e quindi sono in grado di depositare un grande valore di energia quando si stanno per fermare. Ciò permette di trattare tumori in sedi particolarmente difficili, agendo con estrema precisione e preservando i tessuti sani.
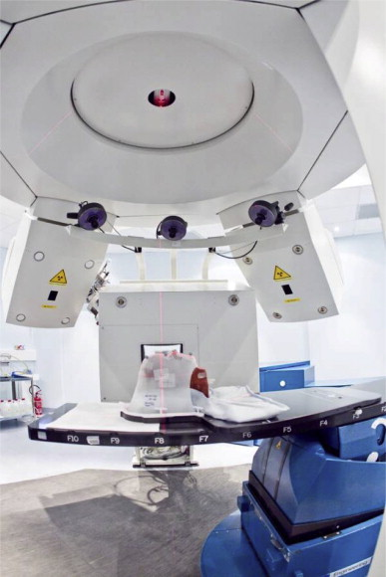
Qual è il futuro per il trattamento dei tumori?
Per quanto riguarda il trattamento con ioni carbonio, un trattamento molto più costoso, è richiesta una tecnica di accelerazione più complessa. Al mondo infatti ci sono pochi centri. Uno di questi si trova in Italia, a Pavia, il CNAO, che sta per Centro Nazionale di Adroterapia Oncologica. Allo CNAO sarà a breve installato anche un acceleratore di particelle per la generazione di campi di neutroni per lo sviluppo di una tecnica radioterapica sperimentale: la terapia per la cattura neutronica del boro (Boron Neutron Capture Therapy, BNCT). Tale terapia consiste nella somministrazione di un farmaco in grado di trasportare all’interno delle cellule tumorali un isotopo del boro non radioattivo, il Boro-10. Il diverso metabolismo di queste cellule rispetto a quelle dei tessuti sani permette che l’isotopo si accumuli in quantità superiore nelle cellule tumorali. Quando il tumore viene irradiato con i neutroni, il nucleo di Boro-10 cattura un neutrone, scatenando una reazione che produce due particelle ionizzanti in grado di distruggere la cellula tumorale.

Lei di cosa si occupa al Politecnico di Milano?
Io lavoro nel Laboratorio di Misure Nucleari ed Elettronica del Dipartimento di Energia. Quello che facciamo noi è studiare e sviluppare rivelatori di particelle innovativi in grado di caratterizzare campi di radiazione complessi, tra cui anche quelli in ambito medicale. Si tratta di campi di radiazione complessi e misti. Ciò di cui ci occupiamo è misurare e analizzare le caratteristiche di questo tipo di campi, con dei rivelatori convenzionali o innovativi, a seconda dell’obiettivo. Per quanto riguarda la radioterapia, ad esempio, la ricerca che ho iniziato durante il dottorato sta nel cosiddetto campo della micro e nanodosimetria. Attualmente nei trattamenti di radioterapia la grandezza su cui si fa sempre riferimento è la dose assorbita, che ha una valenza corretta nel momento in cui si ragiona su volumi macroscopici, ma quando si inizia a scendere su volumi molto piccoli, che sono i volumi delle dimensioni della cellula o delle sottostrutture della cellula (fibra di cromatina o di DNA, dimensioni che vanno dal micron a qualche micron fino a circa dieci nanometri) l’interazione della radiazione con la materia è molto più complessa da descrivere. Se si ragiona in dimensioni molto piccole, entra in gioco la stocastica di interazione tra la particella e la materia. Quindi il concetto di dose assorbita comincia a perdere di validità. L’obiettivo della microdosimetria è proprio quello di andare a studiare l’interazione della radiazione con i target e volumi sensibili, che poi portano al danno finale. Per fare questo i rivelatori convenzionali non sono idonei, pertanto si va a lavorare sui cosiddetti microdosimetri, cioè dei rivelatori in grado di simulare queste dimensioni tipiche di una cellula. E la caratterizzazione della reazione con questo tipo di strumenti permette di ottenere delle informazioni sulla qualità del fascio di radiazione, che sono informazioni molto più approfondite.

Qual è il valore aggiunto di fare ricerca al Politecnico?
Essere ingegnere e essere ricercatore al Politecnico porta un valore aggiunto grandissimo. Lavoriamo molto con altri gruppi di ricercatori. Ci rendiamo conto di quanto il fatto di avere delle competenze ingegneristiche ci porta ad avere la capacità di riuscire a sviluppare dei dispositivi. Noi, come ricercatori del Politecnico e come ingegneri, riusciamo a studiare il problema, ma riusciamo anche a fornire una soluzione ingegneristicamente più avanzata, che può portare al salto di qualità, anche solo allo sviluppo di un nuovo rilevatore. Il valore aggiunto quindi è proprio questo, cioè riuscire a lavorare sui parametri, lavorare sull’ingegnerizzazione di un prodotto, per ottenere uno strumento di ricerca e portarlo sempre più verso un utilizzo da parte di un utente finale.