Ingegnere biomedico, ricercatore appassionato e mente curiosa, Mattia Ballerini ha intrapreso un percorso che lo ha portato dal Politecnico di Milano ai laboratori dell’Istituto Europeo di Oncologia, intrecciando ingegneria, meccanica e biotecnologia.
Il cuore del suo lavoro? Gli organi su chip: dispositivi in miniatura capaci di imitare il funzionamento di veri organi umani, ricreati in laboratorio per studiare malattie complesse e testare terapie in modo più realistico, sicuro ed efficace.
In questo articolo Mattia ci accompagna dietro le quinte del suo progetto — gut-on-chip — mostrandoci quanto due mondi apparentemente distanti, come l’ingegneria e la medicina, possano dar vita a tecnologie capaci di rispondere, con il loro grande impatto, alle sfide della salute del futuro.

Mattia, iniziamo da te: ci racconti un po’ il tuo percorso?
Ho svolto tutto il mio percorso accademico al Politecnico di Milano, partendo dalla triennale in Ingegneria Biomedica e proseguendo con la magistrale, sempre nello stesso ambito. Mi sono specializzato in Biomeccanica e Biomateriali (BBB), un indirizzo con un forte focus sulla parte meccanica, anche se col tempo il mio interesse si è spostato verso tematiche più cellulari e legate alla microfluidica.
Già durante la triennale avevo iniziato a esplorare questi temi con una tesi dedicata, e durante la magistrale ho avuto l’occasione di approfondirli lavorando al MiMic Lab, dove mi sono occupato dello sviluppo di un sistema automatizzato per il controllo delle colture nei dispositivi microfluidici.
La svolta è arrivata grazie alla collaborazione con l’Istituto Europeo di Oncologia, nata grazie al dottor Luigi Nezi. Da lì è partita l’opportunità di intraprendere un dottorato, ed è proprio in quel contesto che è nato il progetto su cui sto lavorando ancora oggi.
Com’è nata l’intuizione di usare un modello di “intestino su chip” per studiare la risposta all’immunoterapia nel melanoma?
Tutto è nato dall’incontro tra diverse competenze e visioni. Il dott. Luigi Nezi, oggi Group Leader del Dipartimento di Oncologia Sperimentale dello IEO, arrivava da un’esperienza a Houston, dove lavorava sul microbiota intestinale utilizzando modelli in vivo. Tornato in Italia, voleva esplorare approcci alternativi che gli permettessero di lavorare su sistemi basati su cellule umane, mantenendo però la complessità strutturale e funzionale tipica di un organo. È qui che entra in gioco il gut-on-chip.
La tecnologia degli organi su chip, su cui il prof. Marco Rasponi, responsabile del MiMic Lab del Politecnico di Milano, ha una lunga esperienza, sembrava offrire il giusto equilibrio: un modello tridimensionale, umano, riproducibile e adatto a simulare condizioni fisiologiche realistiche. È da questa sinergia tra bioingegneria e oncologia che è nato il progetto.
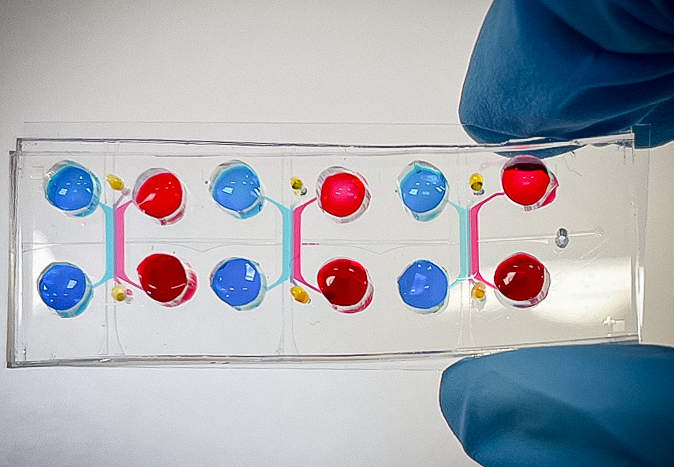
I diversi colori permettono di visualizzare i 3 canali paralleli che formano rispettivamente i compartimenti di cellule epiteliali intestinali, matrice extracellulare e cellule vascolari.
Qual era l’idea alla base?
L’idea era sviluppare un dispositivo in grado di riprodurre fedelmente l’ambiente intestinale umano, per poter indagare il ruolo del microbiota nella risposta all’immunoterapia in pazienti con melanoma. Un tema oggi più che mai centrale, poiché il microbiota si è rivelato un attore chiave non solo nella salute quotidiana, ma anche in molte condizioni patologiche, incluso il cancro.
Il progetto ha avuto sin da subito un buon riscontro: siamo riusciti a sviluppare un modello funzionante, in grado di supportare l’ipotesi sperimentale e riprodurre in vitro le condizioni chiave per studiare l’interazione tra microbiota intestinale e risposta immunitaria nei pazienti oncologici.
Abbiamo dedicato grande impegno a questo progetto, spinti dalla forte motivazione verso un tema che sentiamo particolarmente vicino, e questa costante dedizione ha dato i suoi frutti lo scorso febbraio, quando i risultati principali della nostra ricerca sono stati pubblicati su Nature Biomedical Engineering, confermando il valore del percorso intrapreso.
Puoi spiegarci in parole semplici come funziona il “gut-on-chip”?
Siamo partiti da un dispositivo già esistente al MiMic Lab, inizialmente pensato per il cuore-su-chip. Nonostante le finalità fossero diverse, la geometria era coerente, quindi abbiamo adattato il design per simulare l’intestino.
L’obiettivo principale del gut-on-chip è ricreare, in vitro, non solo l’architettura, ma anche la funzionalità dinamica dell’intestino umano. Nel nostro caso ci siamo concentrati sull’epitelio intestinale, che rappresenta la prima barriera a contatto con il microbiota: quell’insieme di batteri, virus e funghi che vive nel nostro intestino e gioca un ruolo cruciale sia nello stato di salute che nella progressione di molte patologie.
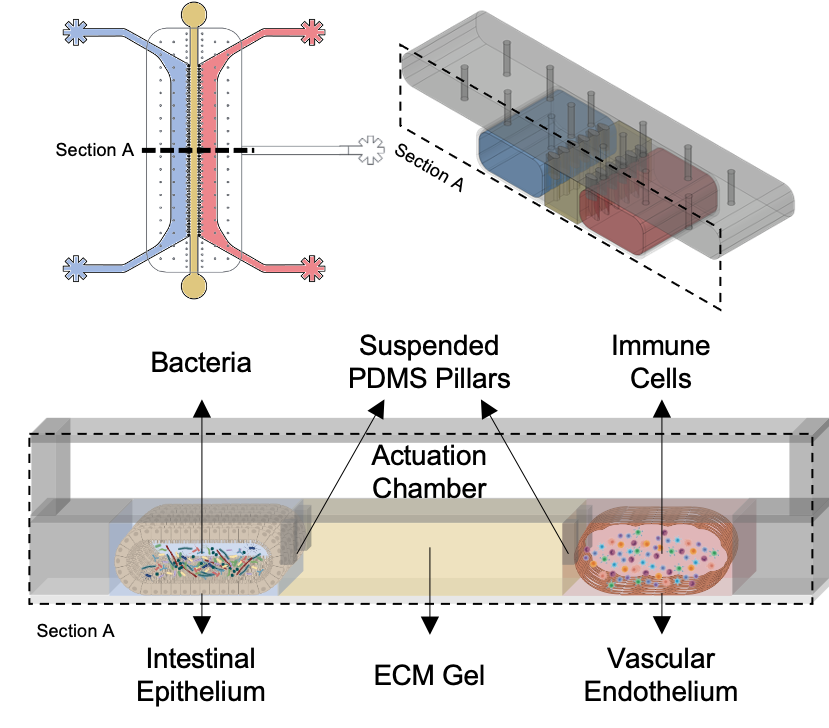
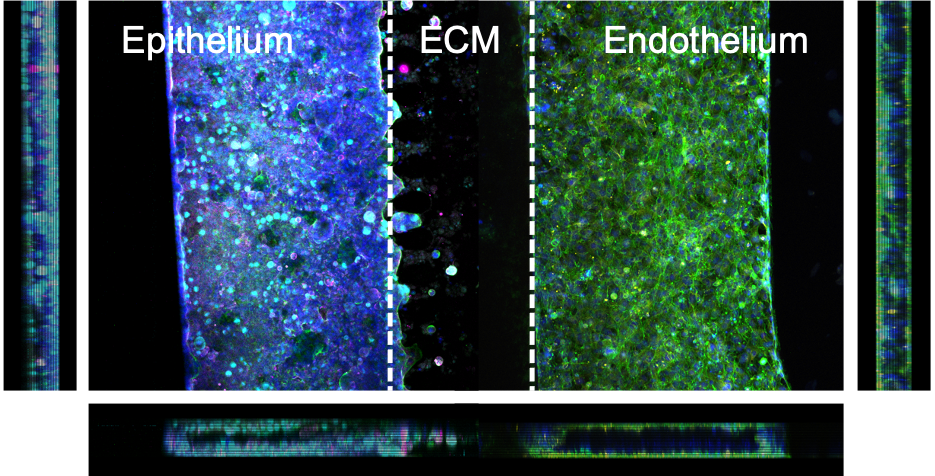
Nel dispositivo abbiamo ricreato questa barriera intestinale utilizzando cellule umane, a cui abbiamo affiancato anche una componente vascolare, per simulare le risposte immunitarie e osservare eventuali effetti a livello sistemico.
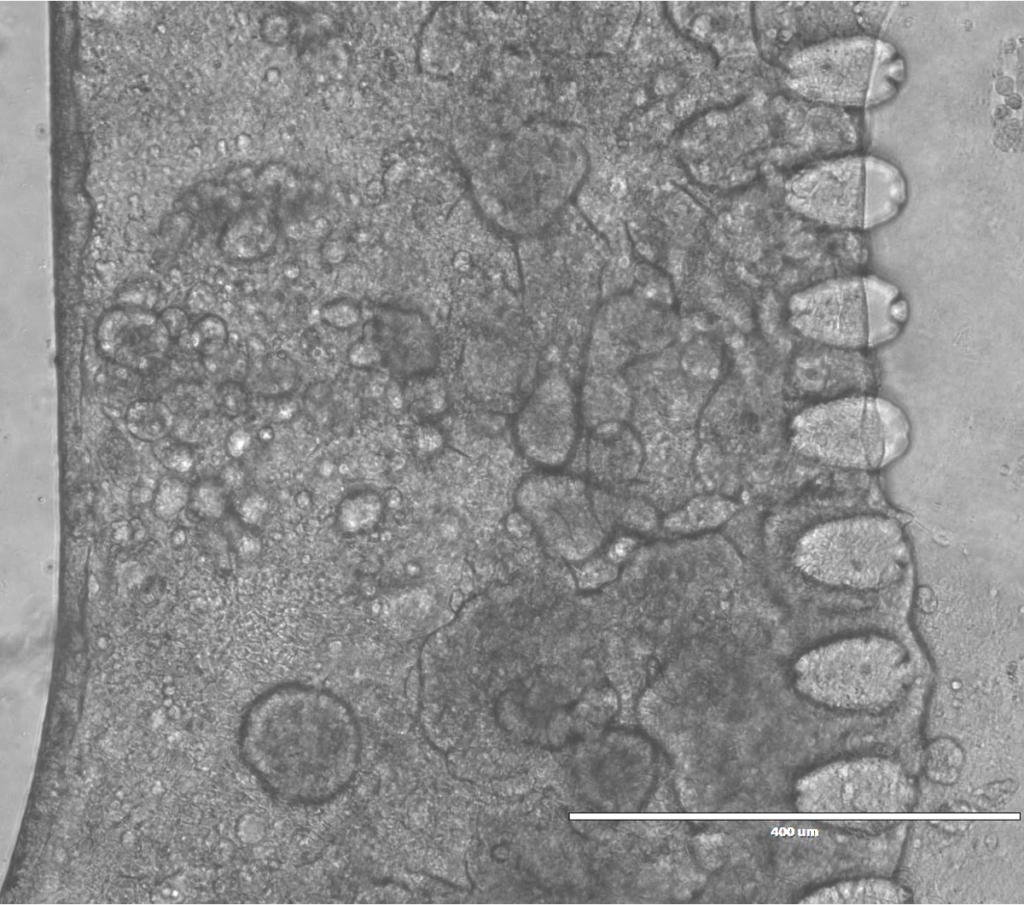
Un elemento chiave è stato l’inserimento della stimolazione meccanica, per imitare i movimenti peristaltici dell’intestino. Questa dinamica si è rivelata fondamentale: in condizioni statiche, le cellule crescono meno e si organizzano in modo più piatto; con la stimolazione, invece, formano strutture più complesse e realistiche, come i tipici villi intestinali, e producono più muco, condizione essenziale per un’interazione equilibrata con il microbiota.
Nel vostro studio avete individuato un legame tra la composizione del microbiota intestinale e l’efficacia dell’immunoterapia nei pazienti con melanoma. Cosa significa questa scoperta in termini clinici?
Abbiamo eseguito una serie di esperimenti di co-cultura, inserendo nel modello sia cellule intestinali umane che campioni di microbiota prelevati da pazienti. Quello che abbiamo osservato è stato che il microbiota di donatori sani o pazienti che rispondevano al trattamento manteneva la barriera intestinale integra, mentre quello di pazienti che non rispondevano all’immunoterapia causava una rottura della barriera e un’infiammazione marcata, che si propagava anche al comparto vascolare, attivando una risposta immunitaria disfunzionale.
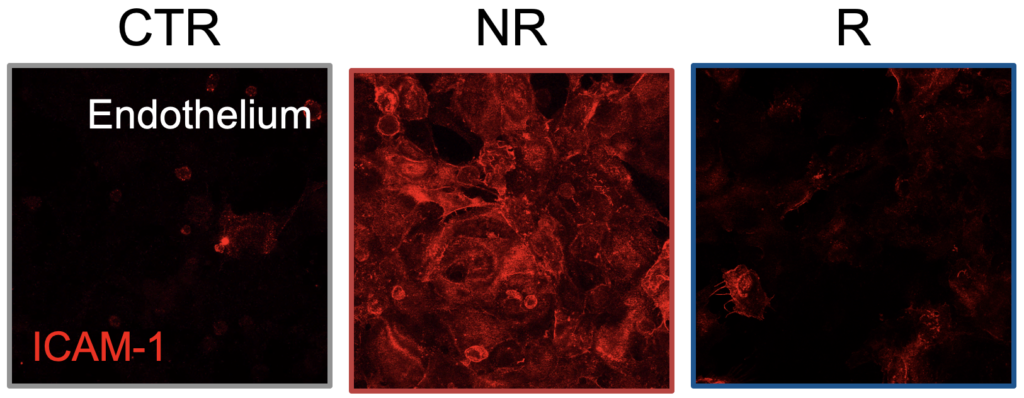
In casi selezionati, abbiamo provato anche a modulare il microbiota di pazienti non responder — ad esempio combinandolo con microbiota di responder — e in questi casi abbiamo assistito a una riduzione dell’infiammazione e a un miglioramento della risposta locale. Questi risultati suggeriscono che, in futuro, potremmo usare dispositivi come il nostro per testare la risposta di un paziente a diverse terapie prima ancora di somministrarle, o persino per manipolare il microbiota e “preparare” il paziente alla terapia.
a tubulo nei canali microfluidici
Pensi che nel futuro questo modello potrebbe estendersi ad altri organi o patologie?
Sì, ed è qualcosa su cui stiamo già lavorando attivamente. La tecnologia uBeat, su cui si basa anche il nostro modello di intestino su chip, ha lo scopo di integrare negli organi su chip un ambiente dinamico, cioè in grado di simulare gli stimoli meccanici — come il battito cardiaco, la respirazione o la peristalsi — che nel corpo umano sono fondamentali per il corretto funzionamento dei tessuti.
Siamo partiti dal cuore, ma oggi stiamo già adattando uBeat ad altri organi: ad esempio, lo stiamo applicando alle articolazioni, per simulare il movimento meccanico della cartilagine durante il cammino o l’attività fisica; oppure ai polmoni, dove la respirazione è un elemento chiave. Ovviamente, lo abbiamo applicato anche all’intestino, per riprodurre i movimenti peristaltici. Ogni volta che introduciamo la stimolazione dinamica, osserviamo un comportamento cellulare più realistico e fisiologicamente rilevante.

Un’altra linea di sviluppo molto interessante, che stiamo attualmente esplorando, riguarda i modelli multi-organo: stiamo creando dispositivi che permettono di mettere in comunicazione diversi organi, ad esempio cuore e fegato, per studiare fenomeni complessi come la cardio tossicità legata alla metabolizzazione epatica di farmaci. In questi modelli, la tecnologia uBeat gioca ancora una volta un ruolo fondamentale.
Infine, stiamo lavorando a un’evoluzione ancora più ambiziosa: la personalizzazione del modello, adattando uBeat alle caratteristiche del singolo paziente. Questo è particolarmente importante, ad esempio, nei modelli cardiaci derivati da cellule staminali, che in vitro spesso non raggiungono un livello di maturazione pari a quello del cuore adulto. L’idea è calibrare la stimolazione meccanica in modo specifico, per ottenere organi su chip sempre più fedeli alla fisiologia umana.
Oggi si parla molto dell’integrazione tra ingegneria e medicina. Secondo te, quanto è importante questa collaborazione per lo sviluppo di terapie più efficaci e meno invasive?
Credo che l’integrazione tra bioingegneria e medicina sia fondamentale per spingere davvero in avanti la ricerca. Anche se oggi in alcuni ambiti queste due discipline viaggiano ancora su binari paralleli, c’è una crescente apertura e volontà di collaborazione, soprattutto nei contesti più interdisciplinari.
Nel mio caso, durante il dottorato, ho lavorato principalmente all’Istituto Europeo di Oncologia, dove mi trovavo a stretto contatto con biologi, biotecnologi ecc. Ero spesso l’unico ingegnere nel laboratorio — e quasi anche in tutto l’istituto [ride] — ma nonostante ciò l’interazione è sempre stata positiva. Ognuno portava sul tavolo le proprie competenze, e da questo confronto nascevano soluzioni più complete ed efficaci.

È chiaro che per certe applicazioni servono conoscenze molto specifiche, e solo attraverso un dialogo reale tra esperti di ambiti diversi si riesce a costruire qualcosa di utile e innovativo. Lavorare insieme ha arricchito molto anche il mio bagaglio personale: grazie alla collaborazione con chi ha un background diverso, sono riuscito a imparare cose nuove, a superare sfide, a raggiungere obiettivi e a contribuire più concretamente al progetto.
Quindi sì, la collaborazione è importante, anzi direi indispensabile, se vogliamo fare ricerca che abbia davvero un impatto.
Dal punto di vista personale, cosa ti ha lasciato questo progetto?
Il dottorato è stato un percorso intenso, durato quattro anni, e come spesso accade, all’inizio ci si scontra con più insuccessi che successi. È una fase in cui bisogna imparare a non scoraggiarsi, a cercare gli aspetti positivi anche quando i risultati non arrivano subito. E non è sempre facile.
Quello che però non è mai venuto meno è stato l’entusiasmo per quello che facevo: ero consapevole di trovarmi in un ambiente stimolante, di lavorare su una ricerca che mi appassionava, e questo mi ha spinto a superare le difficoltà. Ogni ostacolo era una sfida da comprendere e risolvere, non un motivo per fermarsi. E alla fine, i risultati sono arrivati, portando con sé una grande soddisfazione.
Un altro aspetto molto importante è stata l’interazione continua con persone con background diversi dal mio — ingegneri, biologi, medici. Questo confronto mi ha permesso di crescere molto non solo dal punto di vista del mio bagaglio di conoscenze, ma anche a livello personale. In più, sapere che il nostro lavoro può avere un impatto concreto sulla vita dei pazienti dà un senso profondo a quello che facciamo. È un tassello in un puzzle più grande, ma sapere che può essere utile, tangibile, reale, dà grande motivazione.
Guardando avanti: quali sono le tue ambizioni future?
Al momento sono rientrato al Politecnico di Milano come post-doc e sto continuando il mio lavoro al MiMic Lab, concentrandomi sempre sulla tecnologia degli organi su chip. È un ambito che mi appassiona molto, anche grazie all’ambiente stimolante e collaborativo del laboratorio, dove il confronto quotidiano con colleghi rende il lavoro ancora più gratificante.

In futuro, non escludo la possibilità di esplorare strade nuove, come ad esempio applicazioni diverse o applicazioni simili ma più a livello aziendale. Quello che mi interessa è continuare a fare ricerca: sia che avvenga in ambito accademico, sia in un contesto più aziendale, vorrei restare legato a questo mondo, con tutti i suoi pregi e le sue sfide.
Per ora non ho progetti precisi già definiti, ma sto sfruttando il tempo che ho al Politecnico per ampliare le applicazioni delle tecnologie su cui lavoro e, allo stesso tempo, crescere anche dal punto di vista personale e professionale. L’obiettivo è quello di continuare a imparare, sperimentare e contribuire allo sviluppo di soluzioni innovative, magari in ambiti ancora inesplorati.
